Doppelemulsionen revolutionieren die Verkapselung bioaktiver Stoffe in funktionellen Lebensmitteln. Durch innovative Biopolymerkomplexe und Pickering-Stabilisierung werden Probiotika, Mineralstoffe und Peptide vor Abbau geschützt und kontrolliert freigesetzt. Neue Proteinquellen und Mikrofluidik-Technik eröffnen vielversprechende Anwendungen als Basis für Future Foods – von Käsealternativen bis zu spezialisierten Diäten.
Autor: Prof. Dr. Gerald Muschiolik, Food Innovation Consultant
Innovative Verkapselungstechnologien mit Biopolymeren revolutionieren funktionelle Lebensmittel
Während Experten raten, möglichst wenig ultraprozessierte Lebensmittel (UPF) zu verzehren[1], erwartet man von Fertigprodukten, Vollnahrungen oder speziellen Diäten mit funktionellen oder gesundheitsfördernden Zusätzen, die teils ebenfalls zu den UPF zählen, dass diese Zusätze bis zum Verzehr unverändert bleiben. Weiterhin ist für bestimmte Stoffe, die den Magen unverändert passieren sollen, ein geeigneter Verdauungsschutz erforderlich. Hierzu gehören Probiotika, bestimmte Mineralienpräparate (z.B. Ca-Peptid) und auch Mineralstoffe und Peptide mit unangenehmem Geruch oder Geschmack (z.B. Selenpräparate, Muschelpeptide).
Der temperatur- und zeitabhängige Abbau verschiedener bioaktiver Stoffe wird insbesondere in Gegenwart von Sauerstoff und UV-Strahlung beschleunigt. In Kombination mit Biopolymerschichten[2, 3] können Doppelemulsionen (DE), in denen dichte Grenzschichten aus Proteinen und Polysacchariden gebildet werden, diesen Stoffabbau einschränken bzw. verhindern – wie dies auch mit Sauerstoff- und UV-Barrien in Lebensmittelfolien erzielt wird. Detaillierte Informationen hinsichtlich Herstellung, Einsatz und Einschlusseigenschaften derartiger DE wurden 2022 publiziert[4]. In der Zwischenzeit sind viele neue Arbeiten zu dieser Thematik erschienen, von denen ausgewählte Ergebnisse und Fortschritte nachfolgend dargestellt werden.
Inhalt:
- Innovative Verkapselungstechnologien mit Biopolymeren revolutionieren funktionelle Lebensmittel
- Was sind Doppelemulsionen?
- Monodisperse Systeme und Mikrofluidik-Technik
- Schwerpunkte derzeitiger Forschung
- Einsatz von Biopolymeren (Tab. 1)
- Beispiele für besondere Anwendungen von DE-Systemen (Tab. 2)
- Zusammenfassung
- Prof. Dr. Gerald Muschiolik
Was sind Doppelemulsionen?
Hierzu gehören Wasser-in-Öl-in-Wasser- (W1/O/W2) und Öl-in-Wasser-in-Öl-Emulsionen (O1/W/O2). Diese werden den multiplen Emulsionen (z.B. W1/O1/W2/O2) zugeordnet[5]. Der Aufbau der DE und wesentliche Unterschiede in ihrer Herstellung zeigt die Abbildung.
Für spezielle Zwecke (z. B. hohe Anforderungen an eine kontrollierte Stofffreisetzung) werden monodisperse DE mittels Mikrofluidik-Technik erzeugt (z. B. ein W1-Tropfen in einem O-Tropfen, Abb., B1). Hier besteht, wie bei den polydispersen Systemen die Möglichkeit, dass in einem O-Tropfen viele W-Tropfen enthalten sind (durch Vertropfen einer feindispersen W/O-Phase). Die Abbildung zeigt DE mit mehreren W1-Tropfen in einem O-Tropfen (A1) und einen O-Tropfen mit nur einem W-Tropfen (B1). Polydisperse W-Tropfen können auch mehrere oder sehr viele O-Tropfen enthalten (A2). Die folgenden Ausführungen konzentrieren sich auf die Variante A1 und A2. Abbildung 2 zeigt die mikroskopische Aufnahme von DE der Variante A1 in einem Lebensmittelsystem.
Die Herstellung der polydispersen DE (W/O/W) erfolgt überwiegend im Zweischrittverfahren. Im ersten Schritt wird eine W1-Phase mit hohem Energieeintrag in Öl oder Flüssigfett emulgiert (Abb., A1). Die entstandene W1/O-Emulsion wird mit geringerem Energieeintrag in eine W2-Phase dispergiert, um einen hohen Erhaltungsgrad der W1-Phase zu erreichen. Der zweite Schritt kann auch mittels Membranemulgieren oder Mikrofluidik-Technik erfolgen[4, 5].
Je nach Herstellungsbedingungen kann die Verkapselungseffizienz EE der DE bis zu 94 % betragen. Bestimmend dabei ist, die thermodynamische Instabilität, die durch optimale Emulsionszusammensetzung möglichst zu verringern ist, sowie geeignete Herstellungsbedingungen zu wählen. Dabei ist die Einstellung eines geeigneten osmotischen Gradienten zwischen der inneren W1- und äußeren W2-Phase von wesentlicher Bedeutung (höhere Osmolalität in der W1-Phase). Das gilt auch für den Zusatz von DE zu wässrigen Lebensmittelsystemen. Hierzu erfolgten bereits viele Untersuchungen mit dem Ziel, einerseits die Stabilität der DE und somit EE zu erhöhen und andererseits die Stofffreisetzung den Anforderungen anzupassen (z.B. spontane Freisetzung).
![Methoden zur Herstellung von Doppelemulsionen
[4, 5]](/media/story_section_image/31799/img-01-muschiolik-abb-1-doppelemulsionen-und-mikrofluidik-cit0925.jpg)
[4, 5]
Monodisperse Systeme und Mikrofluidik-Technik
Zur Erzeugung monodisperser Systeme wird die Mikrofluidik-Technik eingesetzt (siehe Variante in Abb. oben). Definierte W1-Tropfen werden hierbei in einen definierten O-Tropfen eingeschlossen (einzeln oder mehrere). Die O-Phase bildet nach Vertropfen eines einzelnen W1-Tropfens in die W2-Phase eine Verkapselungsschicht („Schale“). Gegenüber den polydispersen Systemen werden hierbei größere Tropfen gebildet. Weitere Varianten von Mikrofluidik-Techniken und monodisperser Systeme werden in[4] erläutert.
Mit der Mikrofluidik-Technik lassen sich auch DE für den Lebensmittelbereich mit enger Tropfen-Größenverteilung erzeugen. Hierbei kann die O/W-Grenzfläche (O-Tropfen ∅ 100 bis130 µm) z.B. durch Molkenprotein-Mikropartikel mit Hydroxypropylmethylzellulose (HPMC) stabilisiert werden[6].
Enthalten definierte O-Tropfen eine feindispergierte W-Phase, gestatten Na-Caseinat/Chitosan-Komplexe die Stabilisierung der O/W-Grenzflächen (O-Tropfen d4.3 ∼44 µm)[7]. Mit derartigen „Composite Particles“ bzw. biobasierten Mikropartikeln[6] hergestellte Doppelemulsionen werden auch als „Pickering Double Emulsions“ (PDEs) bezeichnet[48].
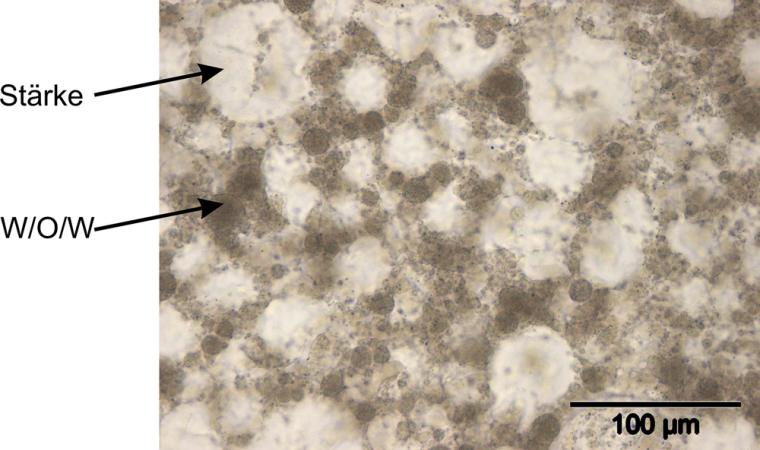
Schwerpunkte derzeitiger Forschung
Mikrofluidiktechnik
Die Forschung zur Anwendung der Mikrofluidik-Technik konzentriert sich derzeit auf die Optimierung der Fließbedingungen in den Mikrokanälen[8, 9, 10] und auf die Erzeugung definierter Kapselformen durch Polymerisation oder Vernetzungsreaktion[11]. Weiterhin liegen numerische Studien zur gezielten Elektrokoaleszenz definierter Tropfen (z.B. für Tropfen mit unterschiedlichen Reaktanten) unter Wechselfeld-Dielektrophorese vor[12].
Polydisperse Systeme
Während die für die Stabilität der W/O/W-Systeme wichtigen Parameter bekannt sind[4] und die Partikelstabilisierung („Pickering-Stabilisierung“) sich inzwischen etabliert hat, nehmen derzeit das Einstellen einer bestimmten Grenzflächenstabilität, die kontrollierte Stofffreisetzung und das Optimieren der Partikelstabilisierung einen breiten Raum in der Forschung ein.
DE-Erzeugung im Einschritt-Verfahren
Die gegenwärtigen Untersuchungen konzentrieren sich darauf, DE mittels Einschrittverfahren zu erzeugen. Zur Grenzflächenstabilisierung von W/O/W werden dabei verschiedene Biopolymerkomplexe (z.B. Chitosan/Soja-β-Conglycinin[13] und Pilzproteinpartikel (Pleurotus geesteranus)[14] eingesetzt.
Um auf diese Weise ein Fettsubstitut mit hohem Wassergehalt zu erhalten, wird zuerst Sojaöl unter Zusatz von Oleanol-Partikel mit bis zu 80 % Wasser angereichert und die erhaltene W1/O-Phase mit einem W2-Mikrogel (Erbsenprotein/Xanthan) homogenisiert[49]. Auch O/W/O-Systeme sind z.B. unter Zusatz von Phytosterol/Chitosan-Komplexe im Einschritt-Verfahren herstellbar[15] .
Emulgatoreinsatz, Grenzflächenstabilisierung
Während zur DE-Erzeugung auch noch klassische W/O-Emulgatoren (PGPR und Span 80) eingesetzt werden, finden für die Stabilisierung der O/W-Grenzflächen zunehmend Biopolymere Verwendung (Tab. 1). Hierzu gehören Komplexe aus geladenen Biopolymeren und Biopolymer-Nanopartikel (insbesondere denaturierte Proteine und feindispergierte Polysaccharid-Partikel mit definiertem Grenzflächenkontaktwinkel Φ. Vorrangige Aufgabe dabei ist, auf den Einsatz synthetischer Emulgatoren zu verzichten[48].
Verzicht auf Polyglycerin-Polyricinoleat (PGPR)
Viele Publikationen berichten über den Einsatz von PGPR, um W/O-Emulsionen zu erzeugen. Doch immer häufiger werden Varianten vorgestellt, die einen Verzicht auf PGPR ermöglichen. Hierzu gehört die Partikelstabilisierung mit bis zu 80 % W in O durch Anreichern von Sojaöl mit Oleanol (z.B. 1,5 %)[49].
Mit PC-abgereichertem Lecithin können stabilere W/O-Emulsionen erzeugt werden, wenn Glucose anstelle NaCl zur Einstellung des osmotischen Gradienten eingesetzt wird[16]. Negativ auf die Stabilität wirkt sich hierbei eine O-Phase mit höherem Ölsäureanteil aus (z.B. Sonnenblumenöl), Neutralöl begünstigt die Emulsionsstabilität. Beim Erzeugen von DE, geeignet als Käsealternative, wird die W1-Phase mit 10 % Gelatine stabilisiert. Diese wird in ein Oleogel (Maiskeimöl mit Bienenwachs) zur Bildung der W/O-Phase dispergiert. Das Stabilisieren der O/W2-Phase mit Caseinat und das Gelieren der W2-Phase (Low-Acyl-Gellan/Na-Alginat) begünstigt die Phasenstabilität der DE[17].
Verzicht auf Tween 20 und Tween 80
Den Anteil an Tween 80 in der W2-Phase zu senken, ist möglich, wenn z.B. der Emulgator mit γ-Aminobuttersäure (GABA) 1:1 kombiniert wird[18]. Auf Tween 80 und Tween 20 kann verzichtet werden, wenn Proteine (nativ oder modifiziert) zur Bildung und Grenzflächenstabilisierung von O/W-Emulsionen eingesetzt werden oder eine Stabilisierung mittels Nano- oder Mikropartikel erfolgt[4]. In O/W/O-Emulsionen führen Proteine in der W-Phase im Vergleich gegenüber Tween 80 ebenfalls zur höheren Emulsionsstabilität[19].
Einsatz von Biopolymeren (Tab. 1)
Biopolymerkombinationen zur Grenzflächenstabilisierung
Biopolymere einzeln oder als Komplex verbessern die Langzeitstabilität von O/W-Grenzflächen. Dabei lassen sich die Grenzflächenstabilität und somit das Freisetzungsverhalten beim Einsatz von Komplexen über die Biopolymeranteile (z.B. MPI/ HV-Pektin) regulieren[24]. Als Biopolymere werden bisher insbesondere Proteine nativ, Protein-Polysaccharid-Komplexe, Polysaccharid-Polysaccharid-Komplexe und ternäre Komplexe (sprühgetrocknet aus Gelatine/Epigallocatechingallat/Pektin[25]) zur Grenzflächenbildung verwendet.
Für die zunehmend praktizierte Partikelstabilisierung (Bilden von PDEs) sind neben denaturierten Proteinen auch Polysaccharidpartikel (z.B. Zellulose) und Protein-Polysaccharid-Komplexe zu finden. Die Partikelstabilisierung von Doppelemulsionen (Einsatz von biobasierten Nano- bzw. Mikropartikel) eröffnet die Möglichkeit, für die Lebensmittelanwendung auf synthetische Emulgatoren zu verzichten und DEs mit hoher Stabilität herzustellen[48]. Gleichzeitig lässt sich so das Anwendungspotenzial der DE erweitern und auch größere Emulsionstropfen stabilisieren[4].
Grenzflächenstabilität im oberen Verdauungstrakt (kontrollierte Freisetzung)
Eine große Herausforderung ist der Schutz von bioaktiven Verbindungen sowie von Probiotika in der Magenpassage. Hierfür werden die Grenzflächen mit Polysacchariden stabilisiert, die Ballaststoffeigenschaften aufweisen (z.B. Chitosan und HPMC bzw. ionische Polysaccharide oder ionische Polysaccharid-Gemische). Diese bilden stabile Komplexe mit den emulgierenden Proteinen.
Auch denaturiertes und partikuliertes Glykoprotein Ovomucin (OM) aus Hühnereiweiß ist hierfür geeignet. Zur Stabilisierung der O/W2-Grenzfläche eingesetzt, erhöht OM die Säurestabilität von Companilactobacillus crustorum in der W1-Phase[19]. Dieser Bazillus inhibiert pathogene Keime und wird zur Behandlung von Colitis ulcerosa eingesetzt.
Mit Komplexen aus Molkenprotein/Gummi arabicum wird neben der Magensaftresistenz zusätzlich die Hitzestabilität von gefriergetrocknetem L. plantarum erhöht. Eine höhere Überlebensrate des Lactobacillus lässt sich auch feststellen, wenn die W1-Phase Sojasaponin und die W2-Phase So-japrotein enthält. Ein hoher Verdauungsschutz im Magen für Laktobazillen ist ebenso mit Na-Alginat/Chitosan-Hydrogel (W2-Phase) und mit kombiniertem Einsatz von Chitosan (W1-Phase) und HPMC (W2-Phase) gegeben.
Beispiele für besondere Anwendungen von DE-Systemen (Tab. 2)
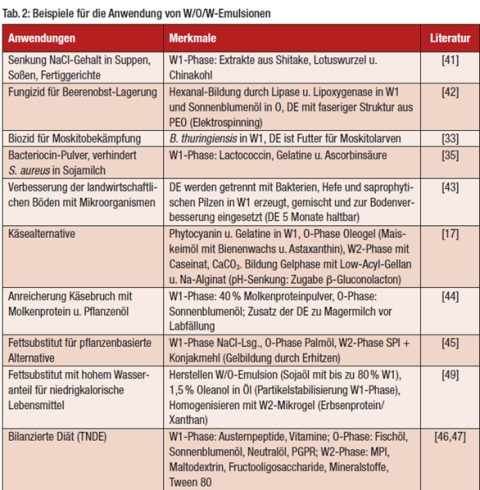
Wenn DE den Kochsalzanteil in Gerichten senken sollen, indem sie etwa den würzigen Geschmack durch Freisetzung von Pflanzenextrakten aus der W1-Phase verstärken, muss die Emulsion so stabil sein, dass sie den Scherkräften beim Verzehr standhält und die W1-Phase im Mund freigesetzt wird. Beim Einsatz von DE als Fungizid (durch Hexanalbildung) wird auf stabilisierende Biopolymere verzichtet. Hier erfolgt der Einschluss der DE in eine Polyethylenoxid-Matrix (PEO), durch die das Hexanal diffundieren kann.
Untersuchungen zum Einschluss von B. thuringiensis in DE belegen, dass die Verkapselung mit Na-Lignosulfat/Chitosan-Komplex einen guten UV-Schutz für Mikroorganismen bildet. Die DE eignet sich als Futter für Moskitolarven und deren Bekämpfung.
Derartige Komplexe erhöhen auch die Stabilität bei der Sprühtrocknung (Herstellung von Bacteriocin-Pulver).
Besonders interessant ist die getrennte Herstellung von DE mit verschiedenen Mikroorganismen, die sich nach dem Vermischen der DEs nicht gegenseitig beeinflussen und somit als Mikroorganismen-Compound eingesetzt werden können. Hier bieten sich neben der Landwirtschaft weitere Anwendungen an (z. B. Biotechnologie). Die Beispiele für DE als Basis für Alternativprodukte (z. B. Käse), zum Anreichern von Käseprodukten mit Pflanzenöl, als Fettsubstitut oder zur Herstellung bilanzierter Diäten verdeutlichen, dass DEs als Grundlage für Future Foods geeignet sind.
Zusammenfassung
Die Zahl der Publikationen zum Einschluss verschiedenster Stoffe und zur kontrollierten Freisetzung in DE nimmt stetig zu. Die Stabilität und Verkapselungseffizienz der DE hängt von der Herstellungstechnologie, der Grenzflächenstabilisierung und der Zusammensetzung der W- und O-Phasen und dem osmotischen Gefälle zwischen den Phasen ab. Derzeit konzentriert sich die Forschung auf den Einsatz grenzflächenaktiver Biopolymere, um die Verkapselungseffizienz zu erhöhen. Dabei werden neue Varianten von Biopolymerkombinationen zur Bildung von Komplexen oder von Biopolymer-Mikro/Nanopartikel zur Pickering-Stabilisierung (Erzeugen von PDEs) getestet. Weiterhin werden verstärkt Oleogele als O-Phase zur Emulsionsstabilisierung eingesetzt. Gegenwärtig steht die Nutzung von DE als Lebensmittelzusatz mit eingeschlossenen bioaktiven Komponenten und zur Herstellung funktioneller Nahrungen im Mittelpunkt. Während kleintechnische Lösungen zur Bildung von DE mit unterschiedlichem Energieeintrag und zum Erzeugen partikelstabilisierter DE ausreichend beschrieben werden, lassen geeignete großtechnische Verfahren zur Emulsionsherstellung noch auf sich warten.

Prof. Dr. Gerald Muschiolik
Food Innovation Consultant
© Muschiolik
[1] Wang, L. et al. (2024), J. Academy of Nutrition and Dietetics, https://doi.org/10.1016/j.jand.2024.11.014
[2] Ezati, E. et al. (2023), Food Hydrocolloids 142,108771.
[3] Mishra, B. et al. (2024), Int. J. of Biol. Macromol. 279, 135583.
[4] Muschiolik, G. (Hrsg.) Multiple Emulsionen, Herstellung und Eigenschaften. 2. Auflage, Behr´s Verlag Hamburg, 2022.
[5] Muschiolik, G. (2022), LVT LEBENSMITTEL Industrie 4, 26.
[6] Nie, Ch. et al. (2025), Food Hydrocolloids 163, 111046.
[7] Kuroiwa, T. & Hamada, S. (2023), Food Hydrocolloids 137, 108335.
[8] Fan, L.-L. et al. (2024), Chem. Engin. J. 498, 155727.
[9] Oveysi, M. et al. (2024), Int. J. of Multiphase Flow 170, 104645.
[10] Malaksha, V.M. et al. (2024), Chem. Engin. Res. and Design 203, 165.
[11] Mosheni, A. et al. (2024), Anal. Chim. Acta 1309, 342573.
[12] Liu, W. et al. (2023), Chem. Engin. Sci. 277, 118877.
[13] Chen, J. et al. (2023), Food Hydrocolloids 138, 108465.
[14] Jin, M. et al. (2024), Food Hydrocolloids 151, 109789.
[15] Sun, Y. (2024), Food Hydrocolloids 147, 109419.
[16] Hu, Y. & Van der Meeren, P. (2024), J. of Food Engin. 381, 112192.
[17] Zhang, P. et al. (2024), Food Biosci. 57, 103536.
[18] Liu, M.-Q. et al. (2025), J. of Molecular Liquids 425, 127221.
[19] Zhi, Z. et al. (2024), Food Hydrocolloids 148, 109488.
[20] Sun, B. et al. (2025), Food Hydrocolloids 163, 111060.
[21] Wang, K. et al. (2025), J. of Cereal Sci. 121, 104103.
[22] Camelo-Silva, C. et al. (2025), Food Chem. 463, 141542.
[23] Pei, T. et al. (2025), Food Hydrocolloids 160, 110771.
[24] Gharehbeglou, P. et al. (2024), J. of Agric. and Food Res. 17, 101261.
[25] Huang, X. et al. (2023), J. of Food Engin. 338, 111259.
[26] Yan, X. et al. (2024), Int. J. of Biol. Macromol. 270, 132313.
[27] Gao, Y. et al. (2025), Food Hydrocolloids 160, 110834.
[28] Shen, Y. et al. (2025), Int. J. of Biol. Macromol. 287, 138516.
[29] Tang, K. et al. (2024), Int. J. of Biol. Macromol. 282, 137098.
[30] Chen, Y. et al. (2025), Int. J. of Biol. Macromol. 298,139982.
[31] Zhou, Y. et al. (2024), LWT - Food Sci. and Technol. 199, 116100.
[32] Li, Y. et al. (2024), Food Hydrocolloids 153, 109956.
[33] Wu, H. et al. (2024), Carbohyd. Polym. 354, 123346.
[34] Zhang, Q. et al. (2024), Food Chemistry: X 22, 101260.
[35] Peng, Z. et al. (2024), Food Biosci. 57, 103597.
[36] Zhu, X. et al. (2025), LWT - Food Sci. and Technol. 218, 117428.
[37] Li, R. et al. (2025), Food Hydrocolloids 164, 111228.
[38] Hwang, W. et al. (2024), Int. J. of Biol. Macromol. 264,130562.
[39] He, J. et al. (2023), Int. J. of Biol. Macromol. 235, 123899.
[40] Xie, F. et al. (2024), Int. J. of Biol. Macromol. 235, 123899.
[41] Lee, J. et al. (2025), Food Chem. 475, 143208.
[42] Ojstršek, A. et al. (2024), Food Chem. 457, 140032.
[43] Ferrari, P.F. et al. (2024), Food and Bioproducts Process. 148, 611–618.
[44] Gamlath, Ch.J. et al. (2023), Food Hydrocolloids 135, 108209.
[45] Ren, Y et al. (2025), Food Chem. 465, 142023.
[46] Li, J. et al. (2024), LWT - Food Sci. and Technol. 212, 116981.
[47] Li, J. et al. (2025), Food Biosci. 64, 105968.
[48] Niroula, A. et al. (2025), Adv. In Colloid and Interface Sci. 343, 103531.
[49] Du, L. et al. (2025), Food Chem. 465, 142121.
[50] Han, M. et al. (2025), Intern. J. of Biol. Macromol. 313, 144238.
Dieser Beitrag ist in CITplus 9/2025 erschienen
Lesen Sie mehr! Aktuelle Nachrichten, meinungsbildende Interviews, detaillierte Marktberichte und fundierte Fachartikel geben CITplus-Lesern den entscheidenden Informationsvorsprung!
Zur aktuellen Ausgabe









